
Les cristaux de silicium et l'électricité
THÈME: Matière et forme
MATHÉMATIQUES / SCIENCES PHYSIQUES
RECONNAITRE UN SOLIDE CRISTALLIN
Pour savoir si un solide est amorphe ou cristallin, on observe la répartition dans la matière des atomes qui le composent. Dans un solide amorphe, les atomes sont désordonnés, alors que dans un solide cristallin, ils sont organisés selon un motif géométrique périodique. Ils sont donc comparables à un pavage réparti également dans l’espace.

La silice est ici sous forme cristalline: on peut repérer un pavage hexagonal qui recouvre l'espace.

La silice est ici sous forme amorphe (ou vitreuse) : il n'existe aucun motif périodique dans la répartition des atomes d'oxygène et de silicium. Ce schéma est une représentation du verre tel que nous l'entendons, c'est pourquoi le verre appelé cristal n'est oas réellement un cristal, les termes verre et cristal s'excluant mutuellement.
Cette périodicité des atomes entraine de nombreuses propriétés propres aux solides cristallins.
On distingue trois types de solides cristallins:
-
Les cristaux ioniques, composés d'ions. La cohésion entre les ions est alors très forte, et assurée par l'interaction électrique (ou coulombienne)
-
Les cristaux covalents, composés d'atomes. La cohésion entre les atomes est ici assurée par les liaisons covalentes entre les atomes.
-
Les cristaux moléculaires, composés de molécules. La cohésion entre les molécules étant assurée par des liaisons de Van der Waals ou par des liaisons hydrogène est par conséquent assez faible.
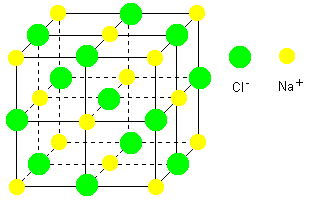
Un cristal ionique de NaCl, pius connu comme étant le sel de cuisine.


Le cristal covalent du carbone: le diamant.
Le cristal moléculaire de l'eau: la glace.